Cell:AI时代的蛋白质从头设计 |
 |
来源:生物世界 2024-12-26 11:56
该文章讨论了基于物理学的建模方法和人工智能(AI)相结合的背景下,蛋白质从头设计领域的当前状态。蛋白质能够将化学反应的速度提高许多个数量级,将光能转化为化学能,并以维持生命所需的度调节细胞和生物体内的无数过程。天然蛋白质由于具有这些强大的功能,长期以来一直是分子工程中具有吸引力的靶点。
蛋白质工程的目标包括从理解分子和细胞功能的机制到将蛋白质用于催化、生物技术的实际应用,以及作为发现科学和医学的精密工具。
而蛋白质设计正在从从根本上和实际上重新思考上述方法。比起对现有蛋白质的工程化,现在已经可以从头设计和构建具有复杂结构和功能的蛋白质,这些从头设计的蛋白质与自然界中天然存在的蛋白质一样强大,但它们是全新的、用户可编程。
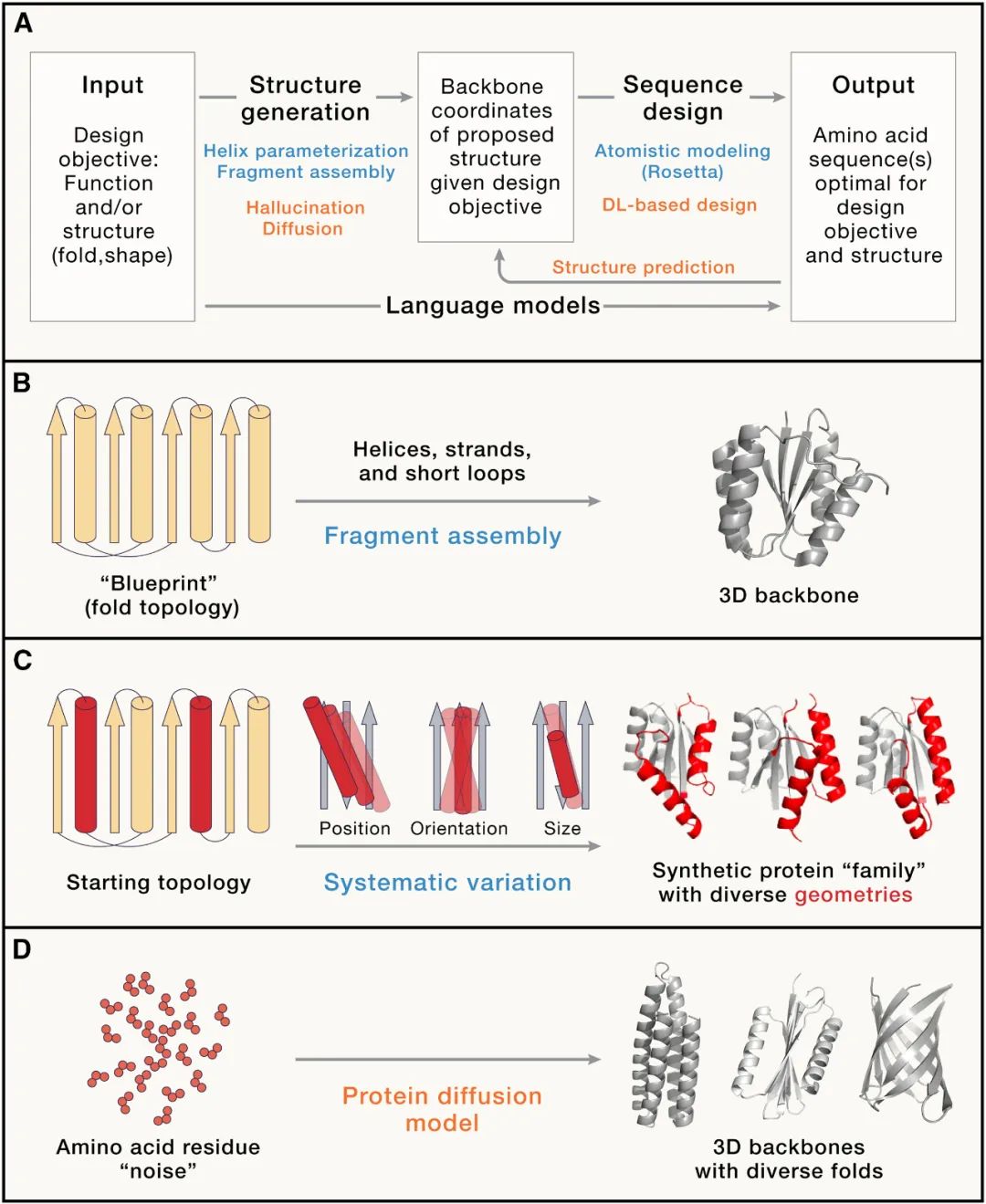
这就是 从头设计 (de novodesign)的概念 如今,基于大型序列和结构数据集训练的人工智能(AI)方法,已经可以 书写 全新的具有新形状和分子功能的蛋白质,而无需从自然界中已存在的蛋白质开始。
2024年2月,加州大学旧金山分校的 Tanja Kortemme 在 Cell 期刊发表了题为:De novoprotein design From new structures to programmable functions(蛋白质从头设计 从新结构到可编程功能)的观点文章。
该文章讨论了基于物理学的建模方法和人工智能(AI)相结合的背景下,蛋白质从头设计领域的当前状态。
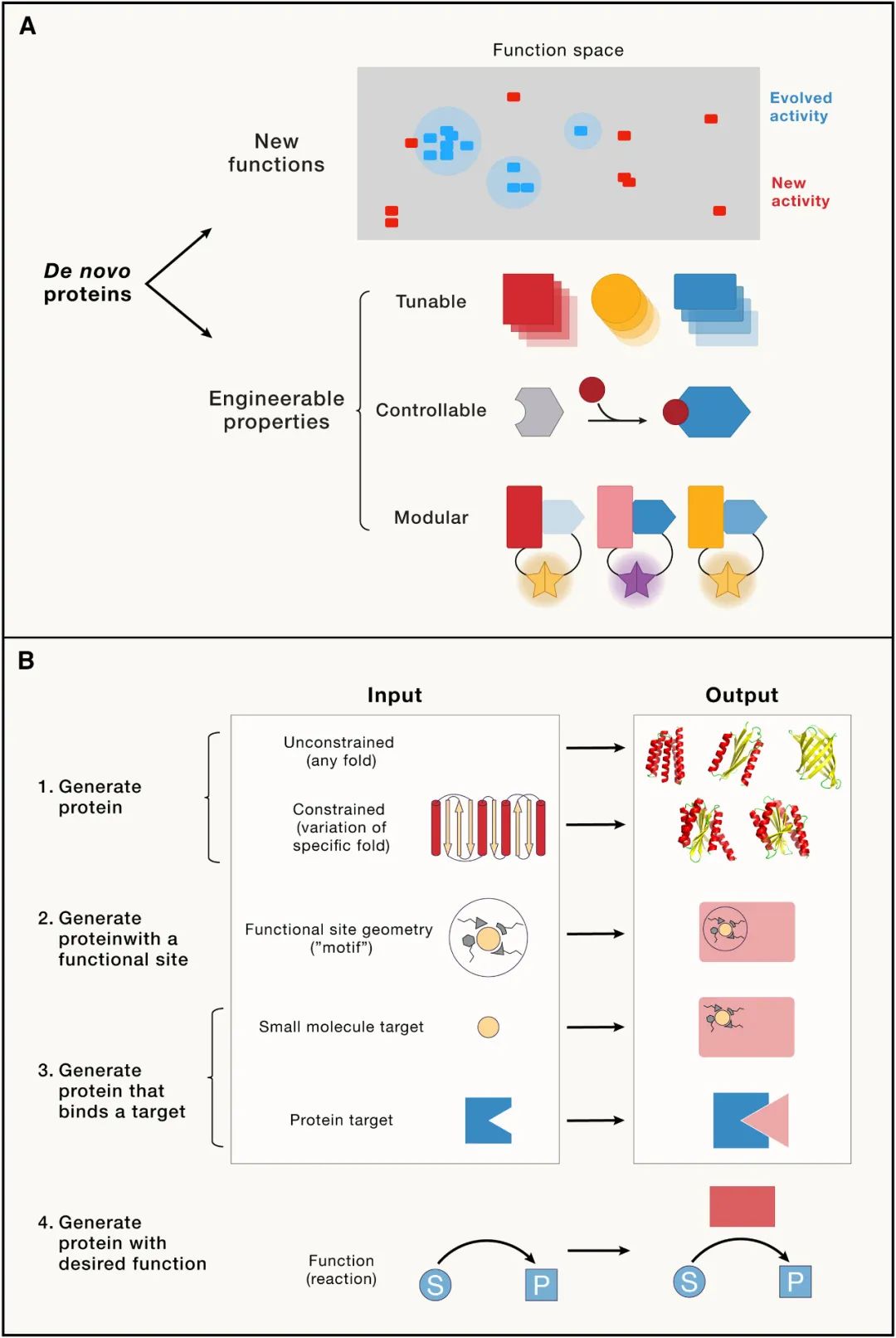
新的蛋白质折叠结构和更高级的组装体可以通过相当高的实验成功率来设计,一些需要对蛋白质构象进行可调节控制和精确的形状互补性以实现分子识别的困难问题也即将得到解决。
一些新兴的方法将工程原理(可调性、可控性和模块化)融入到了蛋白质的从头设计过程。利用从头设计蛋白来结构细胞功能,以及反过来从头构建细胞信号转导系统,是令人兴奋研究前沿。随着方法的改进,还有越来越多的难题等待我们去解决。

对于蛋白质从头设计,人们当然会问 如果可以从自然中现有的蛋白质中借用、再利用和重编程,甚至可以从现有蛋白质中获得新功能,那么为什么要从头设计和构建一切全新的蛋白质呢?
事实上,进化或重组现有蛋白质成分以实现新功能的方法已经取得了令人难以置信的成功,而从头设计由于其明显的局限性而长期落后。设计的蛋白质,即使活性不如天然蛋白质,也需要广泛的筛选工作来提高活性,而且许多想要的功能似乎遥不可及。
但如果我们可以完全从头开始设计功能蛋白,而不考虑进化蛋白的特异质特征,那么可能会有几个明显的优势。首先是启用尚未在自然界中看到的功能(对于这些功能,定向进化没有明显的现有起点)。其次,从头设计可以让我们创造出将工程原理 可调性、可控性和模块化 从一开始就融入设计过程的蛋白质。
我们可以预先设计出具有以下特性的全新蛋白质:1)可调的,这样就很容易产生具有精确改变生化参数的蛋白质;2)可控的,这样就可以使蛋白质的功能对内外刺激做出反应;3)模块化的,这样就可以很容易地将不同的功能集成到复合分子机器和组件中。
AI时代的蛋白质从头设计
蛋白质设计的概念和方法
分子功能的从头设计
从头设计来控制细胞功能
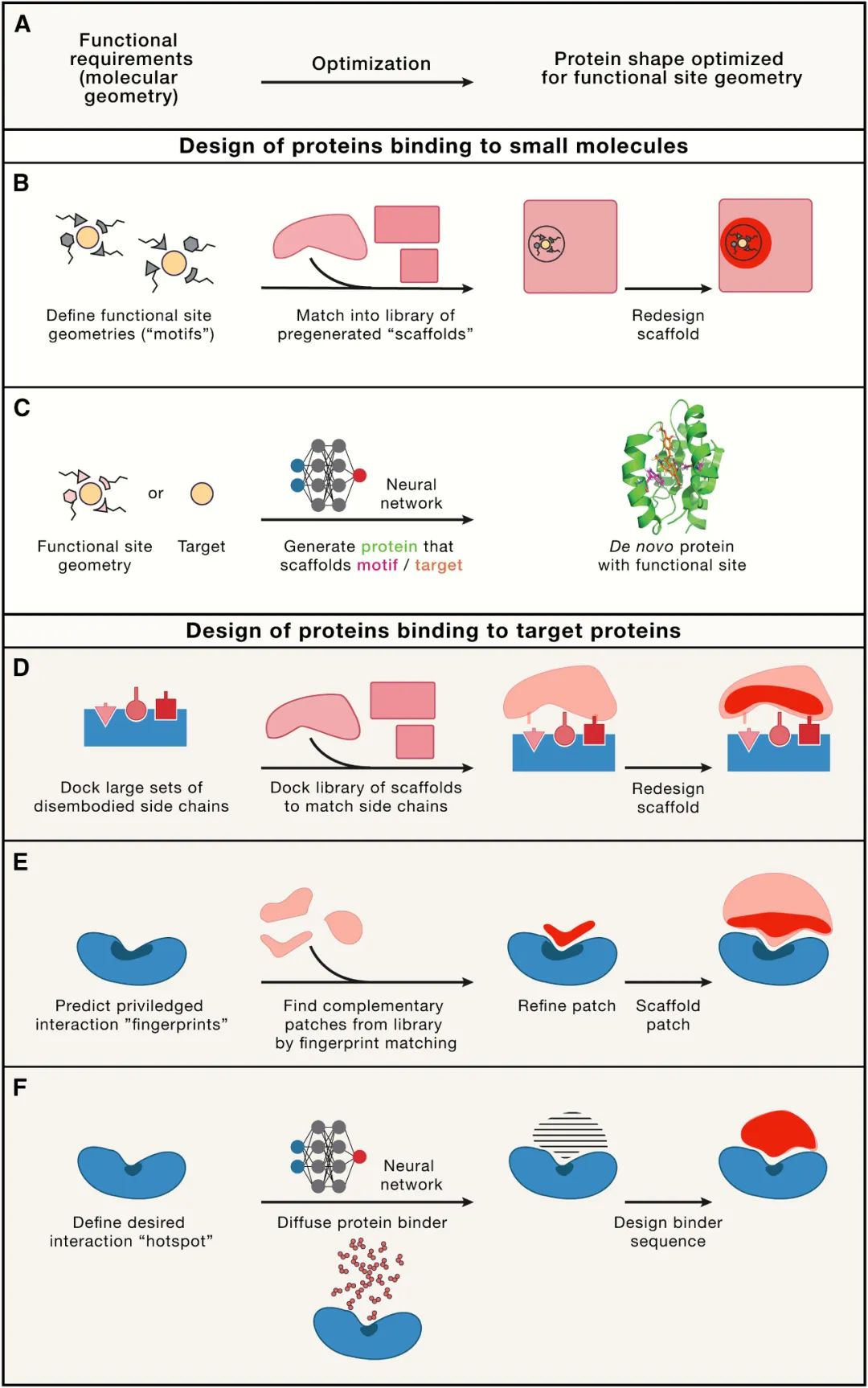
计算从头设计领域的研究正在迈向一个新起点。目前,人工智能在蛋白质设计方面的应用使得许多虽然相对简单,但难度较大的设计目标变得更容易实现,也更加成功。具有多种功能的蛋白质折叠结构甚至大型蛋白质组装体(它们作为疫苗已经具有令人兴奋的临床应用)都可以通过高精度的结构工程来设计。越来越有可能通过基因工程的方式设计出全新蛋白质,使其能够紧密地与目标蛋白质上用户指定的表面结合。这些全新的结合蛋白的应用范围从基础细胞生物学探针到候选治疗药物。
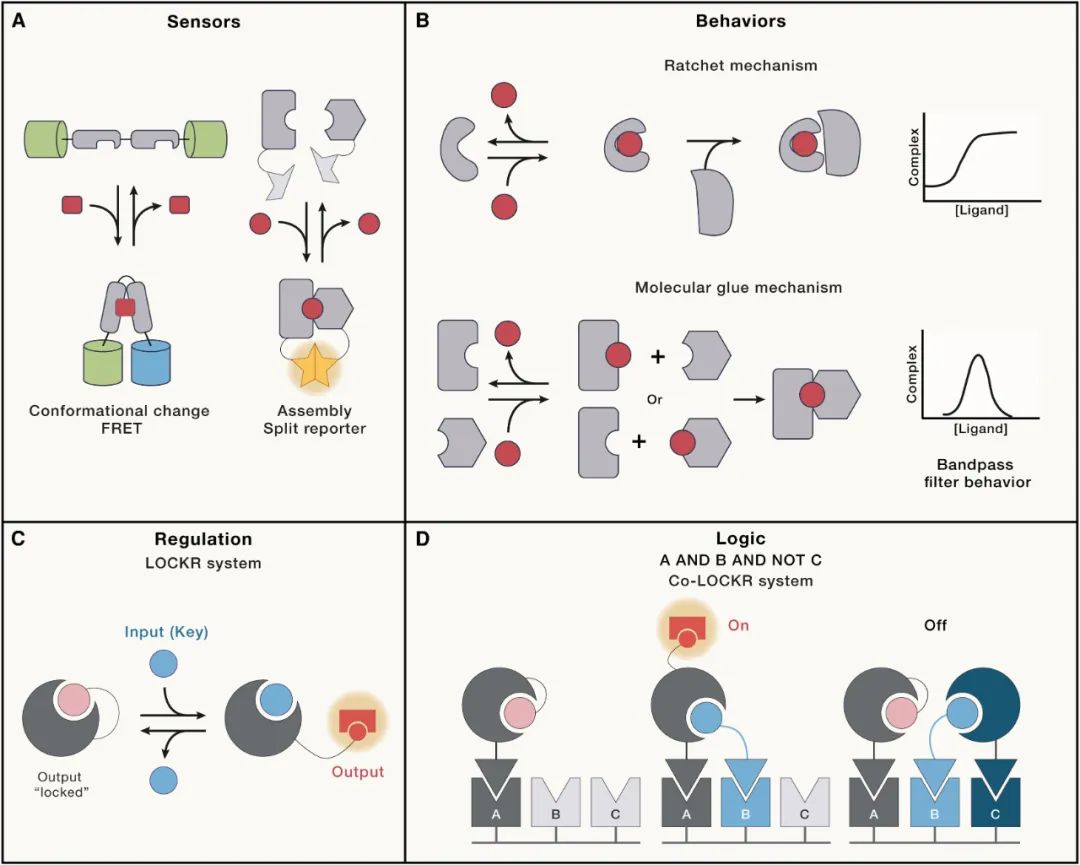
长期以来的目标,例如设计能够感知新小分子信号的蛋白质、设计涉及构象变化和变构作用的高级功能以及工程超灵敏开关等新兴行为,仍然面临重大挑战,但已经触手可及。在将设计系统与生物学进行结合方面也取得了进展,例如控制细胞组装过程的几何形状、位置和时间。
前方有许多令人兴奋的挑战等待着我们。目前的研究前沿包括对蛋白质行为的预测,而不仅仅是其结构:例如,结合亲和力、构象动力学等定量参数,以及最终的细胞功能。深度学习领域的进步需要足够大规模的有价值数据,以实现这些行为的准确设计。
高级蛋白质功能通常是以蛋白质复合体的形式,将输入信号与多种功能输出耦合在一起;因此,预测性设计应该能够整合多个目标。从数据中提取原则对于使所需的蛋白质特性真正可工程化至关重要。新的机遇在于从头开始构建复杂功能,从头设计蛋白质可以根据可调性、可控性和模块化的工程原理预先设计。具有可调性和可控性的新型组件家族可以重新组合以产生各种不同的行为。将这些全新的系统与生物过程进行接口,既能使我们解构细胞功能,又能对其进行控制。蛋白质从头设计领域正迅速发展,为科学家和工程师提供了一个激动人心的环境,以解决许多尚未解决的挑战。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 双效协同,重新定义退热药物的应用 (2024-12-27)
- 研究发现表皮生长因子受体分子胶降解剂 (2024-12-27)
- 清华大学程功团队开发AI语言模型,预测新冠病毒突变和进化 (2024-12-27)
- 传统中药黄芪 (2024-12-27)
- Cell:为何肿瘤抑制基因的“二次打击”模式决定癌症的进程与疗效? (2024-12-27)
- Nature:大脑的“邻里效应”,细胞如何互相加速或延缓衰老? (2024-12-27)
- 基石药业PD (2024-12-26)
- JAMA Neurol:常用的心脏病药物或能减缓亨廷顿氏症患者的疾病进展 (2024-12-26)
- Cancer Cell:揭示HPV和T细胞之间的相互作用让高度突变的正常皮肤保持健康 (2024-12-26)
- Gut:揭示肝纤维化发生的新型机制或有望帮助开发新型个体化靶向性疗法 (2024-12-26)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















