肿瘤治疗新利器!Mater Today Bio:纳米胶囊调节肿瘤代谢,强力提升化学免疫治疗效果 |
 |
来源:100医药网 2025-02-14 11:01
本研究开发出肿瘤微环境响应性纳米胶囊,其在体内外实验中展现出良好的载药及释药性能,可有效抑制肿瘤细胞增殖、诱导免疫原性细胞死亡、调节免疫微环境,显著抑制胰腺癌生长。疗法,尤其是免疫检查点阻断(ICB),为开启了新的篇章,给无数患者带来了希望。然而,免疫抑制性肿瘤微环境(ITM)却像一道难以跨越的屏障,严重阻碍了免疫疗法的疗效。研究发现,肿瘤代谢重编程在ITM的形成中起着关键作用。其中,中吲哚胺-2,3-双加氧酶1(IDO1)的过度表达是一个重要因素。IDO1会加速L-色氨酸(Trp)降解为犬尿氨酸(Kyn),Trp的减少会抑制CD8⁺T淋巴细胞的活性,而Kyn的积累则进一步抑制抗,促进调节性T细胞(Tregs)的产生,抑制细胞毒性T淋巴细胞(CTLs),从而助力肿瘤的生长和转移。因此,抑制IDO1活性、调节肿瘤代谢成为改善免疫治疗效果的关键所在。
近期,一项发表于Mater Today Bio的研究Redox-responsive metal-organic framework nanocapsules enhance tumor chemo-immunotherapy by modulating tumor metabolic reprogramming为肿瘤治疗带来了新的曙光。科研团队成功开发出一种肿瘤微环境响应性纳米胶囊(DNMCs),这种纳米胶囊由酸性和氧化还原敏感的金属-有机框架(MOF)构成,内部封装了阿霉素(DOX)和IDO1抑制剂NLG919。在肿瘤微环境中,DNMCs能够迅速降解,释放出DOX和NLG919,发挥协同治疗的作用,有望显著提升肿瘤化学免疫治疗的效果。

研究人员通过简单的溶剂热反应成功合成了具有规则棒状结构的MOF-SS纳米棒。以MOF-SS为模板制备的DNMCs同样呈现出均匀的纳米棒状,并且具有良好的氧化还原响应性。在模拟肿瘤微环境(pH 5.0、含10 mM GSH)的条件下,DOX释放迅速,86小时的累积释放率高达87.4%;而在模拟生理环境(pH 7.4、含10 M GSH)中,释放率仅为22%。此外,DOX和NLG919在DNMCs中的载药率分别约为21.02 wt%和11.72 wt%。

图 1:DNMCs合成过程示意图
体外实验结果显示,DNMCs能够有效被肿瘤细胞摄取,在的细胞质和细胞核中均能产生较强的荧光信号,这表明它可以高效地将DOX递送至细胞核,发挥其细胞毒性作用。DNMCs对细胞PANC-1的毒性随着浓度的增加而增强,其IC₅₀为0.56 g/mL,明显低于游离DOX的0.8308 g/mL,而对正常细胞HPNE的毒性则较小,具有良好的安全性。
同时,DNMCs在诱导免疫原性细胞死亡(ICD)方面表现卓越,能够促使肿瘤细胞释放更多的损伤相关分子模式(DAMPs),如CRT、HMGB1和ATP等,进而显著促进树突状细胞(DCs)的成熟,增强机体的免疫反应。此外,NLG919有效地抑制了IDO1的活性,降低了Kyn的生成,进一步改善了肿瘤免疫微环境。
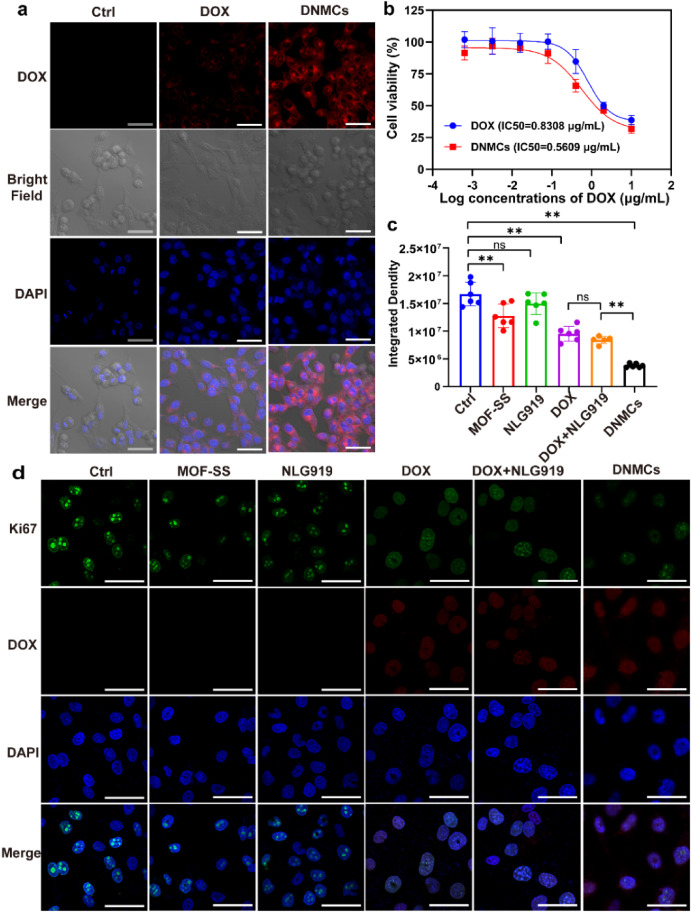
图 2:体外抗肿瘤细胞增殖情况

图 3:体外不同处理组对PANC-1细胞免疫原性细胞死亡(ICD)的影响
体内实验在胰腺癌小鼠模型中展开,结果同样令人振奋。DNMCs展现出了强大的抗肿瘤效果,能够显著抑制肿瘤的生长,其效果远远超过了游离DOX以及两者联合使用的情况。而且,DNMCs具有良好的生物相容性,不会导致小鼠明显的体重下降,对主要器官的损伤也较小。进一步的研究发现,DNMCs在体内能够强烈诱导ICD,促进DCs的成熟,提高干扰素- (IFN- )的分泌,从而增强抗肿瘤免疫反应。同时,它还能降低肿瘤组织中Kyn/Trp的比值,有效抑制IDO1的活性,减少Tregs的浸润,抑制肿瘤细胞的增殖。
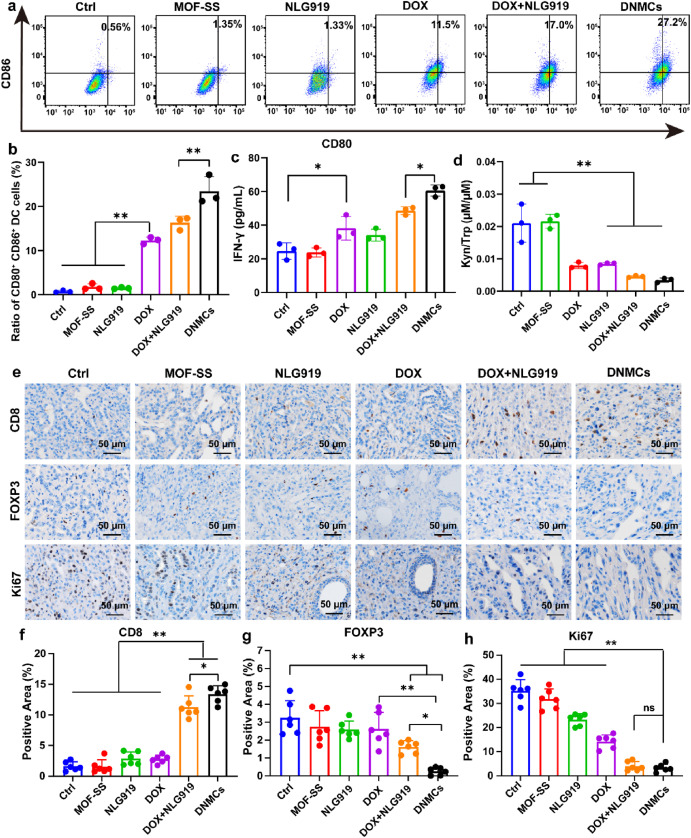
图 4:治疗后肿瘤组织中DCs成熟情况
总体而言,这项研究成功构建了DNMCs,通过调节肿瘤代谢和微环境,显著增强了肿瘤化学免疫治疗的效果。DNMCs凭借其高载药率、肿瘤靶向性和响应性释药的优势,在肿瘤治疗领域展现出了巨大的潜力。尽管目前还处于研究阶段,但它为未来肿瘤治疗指明了新的方向。期待科研人员能够进一步深入研究,推动这一成果早日应用于临床,为广大带来更多的希望,助力人类攻克肿瘤这一重大疾病难题。(100yiyao.com)
参考文献:
Dong Y, Li J, Dai Y, et al. Redox-responsive metal-organic framework nanocapsules enhance tumor chemo-immunotherapy by modulating tumor metabolic reprogramming.Mater Today Bio. 2025;31:101487. Published 2025 Jan 13. doi:10.1016/j.mtbio.2025.101487
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 零糖并不健康!华人学者证实,常见人工甜味剂阿斯巴甜伤害心血管 (2025-02-24)
- eLife:破坏细胞蛋白中的单一氨基酸或能让乳腺癌细胞的行为像干细胞一样 (2025-02-23)
- Cell:新研究揭示DNA错配修复基因在亨廷顿病中起着重要作用 (2025-02-23)
- Cell:一种非工业化饮食可以降低多种慢性疾病的风险 (2025-02-23)
- 影响因子503!医学神刊CA首次发表临床试验论文,来自中国团队 (2025-02-22)
- Cell:新研究表明八种精神疾病具有相同的遗传原因 (2025-02-22)
- 发缝宽、掉发多?Sci Rep毛囊类器官研究:脂质可借HIF (2025-02-21)
- Nature:胰腺癌的神经黑客行动!秘癌细胞如何“策反”神经元加速扩散 (2025-02-21)
- Nature:新研究揭示肠道中的肠嗜铬细胞触发慢性疼痛机制 (2025-02-21)
- 《自然·通讯》:复旦大学附属肿瘤医院团队发现肿瘤肝转移灶的“守护神”! (2025-02-21)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















