Cancer Discov:阻断特殊酶类的功能或能改善黑色素瘤免疫疗法的治疗结局 |
 |
来源:100医药网 2025-04-15 11:29
本文研究不仅揭示了HPGDS在黑色素瘤免疫治疗中的重要作用,还为克服免疫治疗抵抗提供了新的靶点。在癌症治疗的漫长征途中,治疗犹如一束曙光,为众多患者带来了新的希望;尤其是针对瘤这种极具侵袭性的皮肤癌,免疫检查点阻断疗法(ICB)在过去十年间取得了令人瞩目的进展,然而现实总是不尽如人意,大约65%的患者对这种疗法毫无反应,这无疑给医生和患者都带来了巨大的挑战。免疫治疗的核心在于唤醒人体自身的免疫系统,让其去识别并攻击,在这个过程中,肿瘤相关巨噬细胞(TAMs)扮演着关键角色;这些细胞就像是 双刃剑 ,一方面可以协助免疫系统对抗肿瘤,但另一方面其也可能被肿瘤 策反 从而抑制宿主机体的免疫反应,从而促进肿瘤的生长和转移。因此如何重新编程TAMs让其从 叛徒 变回 盟友 成为当前癌症治疗研究的热点之一。
近日,一篇发表在国际杂志Cancer Discovery上题为 Activated T cells break tumor immunosuppression by macrophage re-education 的研究报告中,来自鲁汶大学VIB研究所等机构的科学家们通过研究发现了一种名为血小板生成素D2合酶(HPGDS)的酶或在TAMs中表达,而且与免疫治疗抵抗密切相关,相关研究结果揭示了HPGDS在黑色素瘤免疫治疗中的重要作用,也为克服免疫治疗抵抗提供了新的思路。
文章中,研究人员通过对接受免疫检查点阻断疗法的黑色素瘤患者的基因表达进行分析后发现了一个有趣的现象,即在对治疗无反应的患者中,HPGDS的水平在治疗过程中持续处于高位,而在治疗有效的患者中,随着T细胞被激活并开始攻击肿瘤,HPGDS的表达则显著下调,这就表明,HPGDS可能是逃逸的关键因素之一。进一步实验表明,HPGDS能促进一种名为前列腺素D2(PGD2)的代谢产物的形成,而PGD2就像一个 间谍 ,其会干扰T细胞的正常功能从而使其无法有效攻击;换句话说,HPGDS能通过PGD2这条 暗线 来帮助肿瘤细胞躲过宿主机体免疫系统的追捕。
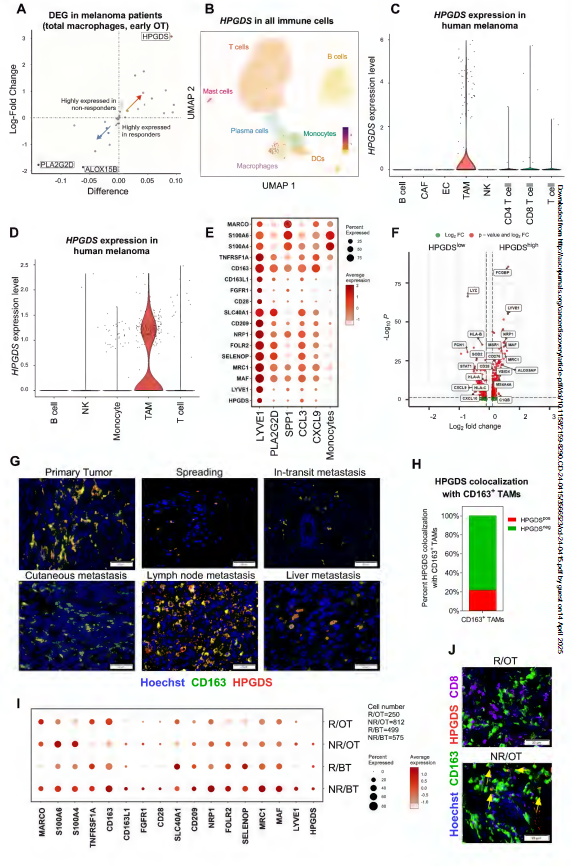
在TAMs亚群中识别出HPGDS
为了验证HPGDS在肿瘤免疫中的作用,Mazzone教授等人采用了多种实验手段,首先他们通过基因编辑技术在小鼠模型中特异性地敲除了TAMs中的HPGDS基因;结果发现,这些经过基因改造的小鼠在面对黑色素瘤时肿瘤生长速度明显减缓,而且肿瘤内的T细胞数量显著增加,且活性也更强,这就说明,一旦切断了HPGDS这条 暗线 ,T细胞就能重新获得攻击肿瘤的能力。更令人振奋的是,当研究人员将这种基因编辑的小鼠与现有的免疫检查点阻断疗法相结合时,发现治疗效果得到了显著提升,因此,HPGDS的抑制不仅能增强T细胞的抗肿瘤活性,还可能克服现有的免疫治疗抵抗问题。
除了基因编辑实验,研究团队还利用药物抑制剂对HPGDS进行了;在小鼠模型和人类化的肿瘤类器官模型中,他们发现,HPGDS抑制剂能显著抑制肿瘤生长并改善肿瘤异常,同时还能减少,这些结果进一步证实了HPGDS在肿瘤免疫中的关键作用,并为开发新的治疗策略提供了有力的证据。
本文研究不仅揭示了HPGDS在黑色素瘤免疫治疗中的重要作用,还为克服免疫治疗抵抗提供了新的靶点。HPGDS抑制剂或PGD2受体阻断剂有望成为新的物,既可以单独使用,也能与现有的免疫治疗药物联合应用,这对于那些对现有免疫治疗无反应的黑色素瘤患者来说无疑是一个巨大的福音。
当然,本文研究还处于早期阶段,后期研究人员还需要在临床试验中进一步验证这些发现的有效性和安全性,但无论如何,这项研究为科学家们打开了一扇新的大门,让他们看到了克服免疫治疗抵抗的希望。未来随着更多研究的深入,我们有理由相信,HPGDS抑制剂将成为抗癌武器库中的重要一员,从而为更多患者带来生的希望。HPGDS的发现就像是在黑暗中点亮的一盏明灯为科学家们指引着前进的方向。(100yiyao.com)
参考文献:
Rosa Trotta,Silvia Rivis,Shikang Zhao,et al. , Cancer Discovery (2025). DOI:10.1158/2159-8290.CD-24-0415.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nature:科学家揭秘DNA损伤修复的幕后英雄,组蛋白H1去酰胺化或为癌症治疗带来新曙光 (2025-04-19)
- Nature:科学家揭示染色体端粒保护新机制——RAP1分子如何阻止端粒融合? (2025-04-19)
- 大阪世博会“再生”奇迹!Nat Commun:人类iPSC衍生原始巨噬细胞培养基,成为心脏病治疗“奇兵”,开启心肌再生新时代 (2025-04-18)
- 优化常见病药品准入机制 4岁患儿在沪胜利用药获救 (2025-04-18)
- AD:健康生活方式可以改命!北大团队发现,健康生活方式对认知相关预期寿命的影响高于APOE基因型 (2025-04-18)
- Cell:当癌症遇上“祖传代码”——你的基因如何预置肿瘤的生存法则? (2025-04-17)
- Sci Adv:炎症或是机体慢性疼痛和抑郁症发生之间的神秘关联 (2025-04-17)
- 青海省公立医疗机构2025年第一季度药品配送环境 (2025-04-17)
- Nature头条:上海交大顾磊磊团队开发AI眼镜,帮助盲人导航 (2025-04-17)
- Nature Methods:你的细胞核正在悄悄变形?颠覆认知的疾病机制革命 (2025-04-17)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















