上海科技大学发表最新Nature论文 |
 |
来源:生物世界 2025-04-26 09:25
这项研究解析了猴痘病毒核心蛋白酶 CorePro 的底物识别及催化机制,为设计针对正痘病毒感染的广谱抑制剂奠定了基础。正痘病毒可引发包括天花(smallpox)和猴痘(mpox)在内的严重疾病,对人类健康构成重大威胁。痘病毒核心蛋白酶(CorePro)对于痘病毒的成熟至关重要,并且在痘病毒中高度保守,使其成为极具吸引力的抗病毒靶点。
然而,CorePro的结构仍不为人所知,这阻碍了抗病毒药物的研发。
2025 年 4 月 22 日,上海科技大学杨海涛教授、上海科技大学/中国科学院上海药物所柳红研究员、清华大学饶子和院士、中国科学院生物安全大科学研究中心张磊砢研究员、重庆医科大学王炜副教授作为共同通讯作者,在国际顶尖学术期刊Nature上发表了题为:Substrate recognition and cleavage mechanism of the monkeypox protease, Core protease的研究论文。
这项研究解析了猴痘病毒核心蛋白酶CorePro的底物识别及催化机制,为设计针对正痘病毒感染的广谱抑制剂奠定了基础。

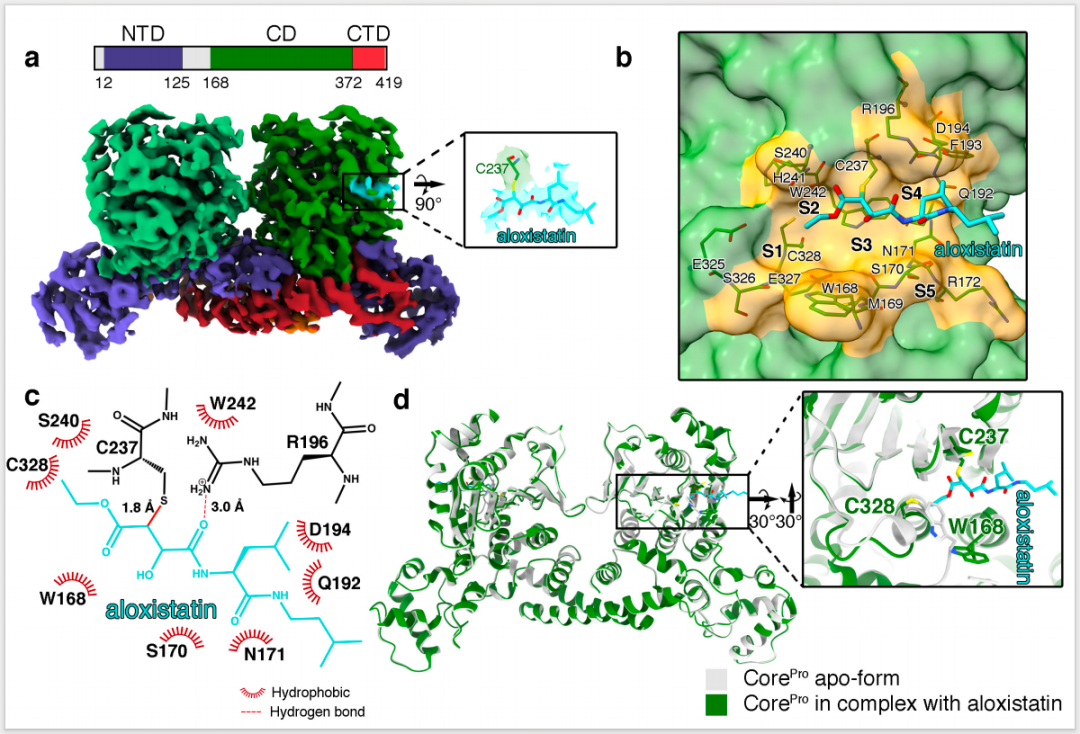
在这项最新研究中,研究团队确定了猴痘病毒(MPXV)的无底物结合时CorePro的结构及其与治疗肌肉萎缩症候选药物阿洛司他汀(aloxistatin)形成的复合物结构。
这些结构表明,CorePro形成同源二聚体,具有独特的 双人舞伴 (dancing-couple)折叠结构,每个单体可分为 N 端结构域 NTD、催化结构域 CD 和 C 端结构域 CTD。活性中心位于催化结构域,包含一个特征的催化三联体 Cys328-His241-Asp258。
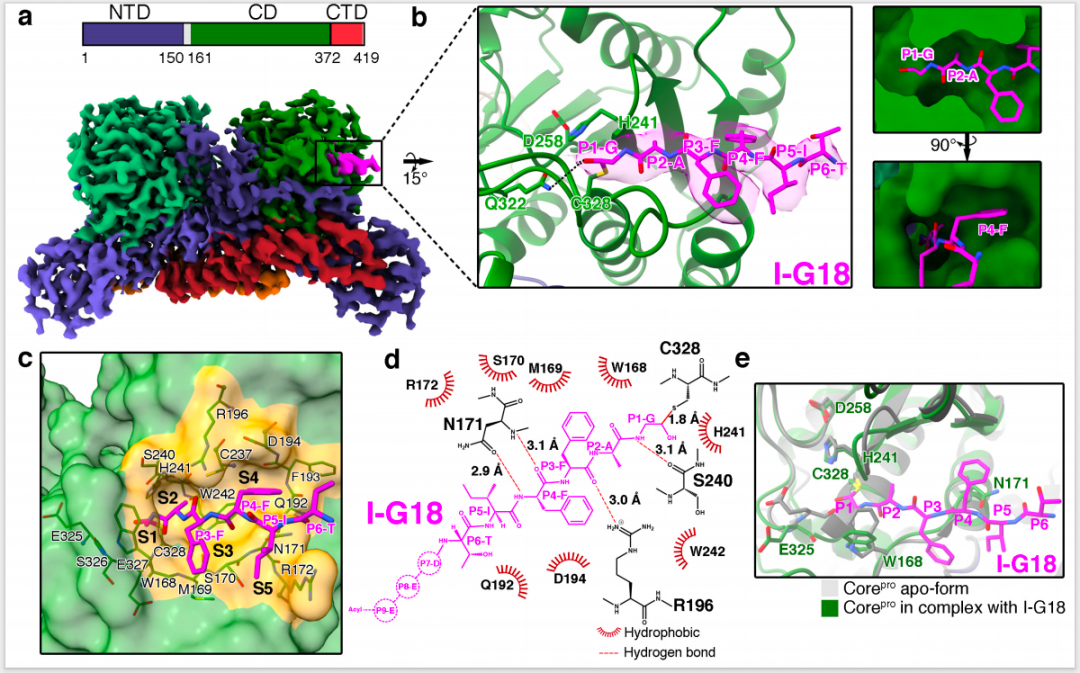
基于核心蛋白酶天然底物P25K序列,研究团队利用醛基替换切割断裂的酰胺键设计了底物类似物 I-G18,能够与催化中心 Cys328 共价结合,模拟催化中间体结构特征,促使病毒蛋白酶的活性位点从无底物结合的闭合构象转变为底物结合时的有利开放构象。
基于CorePro-I-G18 复合物,研究团队随后设计了一系列带有腈基弹头的拟肽抑制剂,它们通过共价锚定 Cys328 发挥作用。这些拟肽抑制剂对CorePro 的IC50 值为44.9-100.3 纳摩尔,表现出了强效且广泛的抗痘病毒活性,有望通过进一步成药性结构优化开发出广谱抗正痘病毒药物。
总的来说,这项研究解析了猴痘病毒核心蛋白酶 CorePro 的底物识别及催化机制,为设计针对正痘病毒感染的广谱抑制剂奠定了基础。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- STTT:揭秘肺癌“钻石突变”ALK的另一面!海内外华人学者合作揭示,RNase1可与野生型ALK结合并激活促癌信号通路 (2025-04-26)
- Nature Medicine:肥胖治疗为何“偏心”?揭秘代谢手术背后的基因“增效密码” (2025-04-26)
- 上海科技大学发表最新Nature论文 (2025-04-26)
- Sci Adv:科学家识别出有望攻克人类最致命脑瘤的关键酶类靶点 (2025-04-26)
- 祝贺!2024全球顶尖学者榜单发布,医学院学者上榜 (2025-04-25)
- Cancer Res:一个新发现的癌症相关成纤维细胞亚群为对抗胰腺癌提供了新策略 (2025-04-25)
- JCI:人类胶质母细胞瘤治疗新突破!科学家发现“病毒模仿术”可增强免疫疗法效果 (2025-04-25)
- 润希靖南基金会正式落户天健国际医疗供应链展贸中心,打造“公益+医疗+产业”新模式 (2025-04-25)
- 每天喝咖啡=少2h睡眠?PNAS Nexus:长期摄入咖啡因会改变睡眠 (2025-04-25)
- 中山大学张锐教授团队开发MIRROR,显著提高RNA编辑效率 (2025-04-25)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















